آنچه در خصوص سدیم می خوانید:
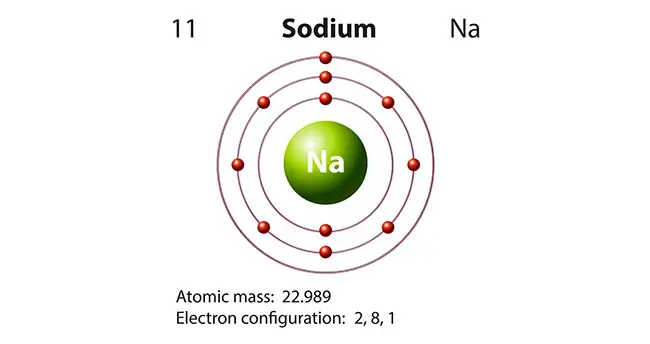
اگر کلاس شیمی دوران راهنمایی و دبیرستان را به یاد داشته باشید، حتماً نام عنصر واکنش پذیر سدیم، به گوشتان آشنا است. به گزارش منابع معتبر، سدیم (Sodium) یکی از عناصر شیمیایی در جدول تناوبی است که نشان اختصاری آن Na بوده و عدد اتمی ۱۱ را به خود اختصاص داده است.
فلز سدیم خواص منحصر به فردی دارد و همچنین منابع بسیار زیادی برای استخراج آن بر روی زمین یافت می شود. از آنجایی که این عنصر واکنش پذیری بسیار بالایی دارد و در دسته فلزات قلیایی قرار می گیرد، شرایط نگهداری منحصر به فردی نیز دارد. اگر می خواهید بدانید که کدام منابع حاوی سدیم هستند و چطور می توان از آن نگهداری کرد، در ادامه این مطلب همراه ما باشید.
سدیم چیست؟
سدیم رایج ترین فلز قلیایی و ششمین عنصر فراوان روی زمین است که ۲.۸ درصد از پوسته زمین را تشکیل می دهد. سدیم یک عنصر فلزی به شدت واکنش پذیر و نرم است که حالت مومی و رنگ نقره ای دارد.
این عنصر که در گروه ۱ جدول تناوبی قرار دارد، به عنوان یک فلز قلیایی شناخته می شود. ترکیبات سدیم در طبیعت به وفور یافت می شوند و یکی از این ترکیبات، کلرید سدیم یا NaCl است که چیزی در حدود ۸۰ درصد از ترکیبات محلول آب دریا را تشکیل می دهد.
فلز واکنش پذیر سدیم در مجاورت با هوا و اکسیژن، اکسید می شود و در مجاورت با آب هم واکنش شدیدی می دهد. به همین علت است که معمولاً این فلز را در نفت و یا روغن نگهداری میکنند.
مشخصات فیزیکی و شیمیایی سدیم
مشخصات فیزیکی فلز قلیایی سدیم که به صورت آزاد در طبیعت یافت نمی شود، در جدول زیر ذکر شده است:
مشخصات فیزیکی | توضیحات |
عدد اتمی | ۱۱ |
جرم اتمی | ۲۲.۹۸۹ |
نقطه ذوب | ۹۷.۶۲ درجه سانتی گراد |
نقطه جوش | ۸۹۲ درجه سانتی گراد |
چگالی فلز | 0.97g/cm³ |
حالت فیزیکی | جامد |
رنگ | نقرهای |
ساختار بلوری | مکعبی مرکز پر |
سختی موس | 0.5 |
در ادامه نیز به مشخصات شیمیایی این عنصر نظیر حالت اکسیداسیون و یا عدد اتمی، در جدول تناوبی اشاره کردیم:
مشخصات شیمیایی | توضیحات |
گروه جدول تناوبی | ۱ |
دوره تناوب | ۳ |
ظرفیت الکترونی | ۱ |
خاصیت الکترونگاتیو | ۰.۹۳ |
شعاع اتمی | 186pm |
انرژی یونیزاسیون اول | ۴۹۵.۸KJ/mol |
واکنش پذیری | بسیار بالا |
محلولیت در آب | محلول در آب |
نیمه عمر | ۱۵H |
به طور کلی فلز سدیم، واکنش پذیری بسیار بالایی با آب دارد و می تواند بعد از واکنش، هیدروژن و هیدروکسید سدیم تولید کند. همچنین می تواند با سایر فلزات واکنش داده و نمک را تشکیل دهد. این عنصر همچنین می تواند با هالوژن ها واکنش دهد و نمک هالید سدیم را به وجود آورد.
نحوه تولید و استخراج سدیم
رایج ترین روشی که برای تولید و استخراج این فلز مورد استفاده قرار می گیرد، الکترولیز سدیم کلرید یا همان نمک طعام مذاب در سلول دانز می باشد. روشهای دیگری نیز برای استخراج و تولید سدیم وجود دارند که هر یک از آنها به شرح زیر هستند:
الکترولیز
در این روش سدیم کلرید مذاب داخل دو سلول یا الکترود گرافیتی (آند) و آهنی (کاتد)، ریخته شده و سپس جریان الکتریکی از الکترودها عبور داده می شود. در آند، یون های الکترون از دست می دهند و به گاز تبدیل می شوند. از طرفی دیگر در کاتد، یون های سدیم الکترون دریافت می کنند و به شکل فلز سدیم Na در می آیند.
کاهش شیمیایی
در این روش، برای احیای سدیم از ترکیباتی مانند اکسید سدیم یا Na2O استفاده می شود. در روش کاهش، از سدیم هیدروکسید (NaOH) مذاب به عنوان الکترولیت استفاده شده و فلز کلسیم به عنوان عامل کاهنده عمل کرده و باعث می شود تا سدیم در کاتد رسوب کند.
تبدیل یونی
در این روش از تبادل یونی بین فلز سدیم و یک فلز قلیایی دیگر مانند لیتیوم در مذاب نمک هایشان استفاده میشود. واکنشی که در تبدیل یونی باعث تولید و استخراج سدیم میشود، به شرح زیر می باشد:
NaCl + Li2O → 2LiCl + Na2O2
استخراج سدیم از نمک طعام
از آنجایی که فلز سدیم به طور طبیعی یافت نمی شود، میتوان آن را از نمک طعام نیز استخراج کرد. برای استخراج سدیم از نمک طعام، از روش های زیر استفاده می شود:
- تبخیر: آب دریا یا آب نمک تبخیر می شود و نمک طعام باقی می ماند.
- حلّالیت: نمک طعام در آب حل شده و ناخالصی ها جدا می شوند.
- تبلور: نمک طعام از محلول اشباع تبلور می یابد.
ترکیبات سدیم
سدیم را می توان در ترکیبات متنوعی یافت و به روش های مختلفی استخراج کرد. برخی از مهمترین ترکیباتی که از سدیم می توان پیدا کرد، به شرح زیر هستند:
- نمک طعام: رایج ترین ترکیب سدیم، نمک طعام یا NaCl است که به عنوان طعم دهنده و نگهدارنده مواد غذایی استفاده میشود. این ترکیب مغذی از کلر و سدیم برای سلامتی انسان ها و بسیاری از حیوانات ضروری می باشد.
- سدیم هیدروکسید: سدیم هیدروکسید یا NaOH یک باز قوی تشکیل شده از اکسیژن، هیدروژن و سدیم است که در صنایع مختلف از جمله تولید صابون، کاغذ و شویندهها کاربرد دارد.
- سدیم کربنات: سدیم کربنات یا Na2CO3، یک ترکیب از این عنصر است که در تولید شیشه و شویندهها و تصفیه آب کاربرد دارد.
- سدیم بیکربنات: سدیم بیکربنات یا Na2CO3 که به عنوان جوش شیرین نیز شناخته میشود، از واکنش کلرید سدیم، آمونیاک و کربن دی اکسید در آب به وجود می آید و در پخت و پز، تولید نان و دارو برای خنثی کردن اسید معده کاربرد دارد.
- سدیم سولفات: یکی دیگر از ترکیبات این عنصر، سدیم سولفات یا Na2SO4 است که ترکیبی از گوگرد، اکسیژن و سدیم است و برای تولید شیشه، انواع شوینده و کاغذ کاربرد دارد.
- سدیم نیترات: NaNO3 یا سدیم نیترات، در تولید کود، مواد منفجره و شیشه استفاده شده و میتواند برای استخراج سدیم مورد استفاده قرار گیرد.
کاربردهای سدیم
فلز سدیم در طیف وسیعی از کاربردها از جمله موارد زیر استفاده می شود.
1. تولید نمک طعام
مهم ترین کاربردی که فلز سدیم دارد، این است که ترکیب نمک طعام را می سازد و رایج ترین ماده مغذی برای انسان و حیوانات را به وجود می آورد. این ماده نه تنها به عنوان طعم دهنده غذا، بلکه به عنوان ماده ای برای حفظ سلامتی و فشار خون مورد استفاده قرار می گیرد. همچنین می تواند برای تولید مواد شیمیایی مانند هیدروکسید سدیم مناسب باشد.
2. تولید مواد شیمیایی
از سدیم برای تولید بسیاری از مواد شیمیایی، از جمله هیدروکسید سدیم، کربنات سدیم و سولفات سدیم استفاده می شود. این مواد شیمیایی در طیف وسیعی از صنایع از جمله تولید کاغذ، صابون، شوینده ها، شیشه و مواد شوینده کاربرد دارند.
3. تصفیه آب
این فلز در ترکیباتی نظیر سدیم هیدروکسید (NaOH) و سدیم کربنات (Na2CO3) برای تصفیه آب و حذف ناخالصیهای آن به کار میرود. به عنوان مثال آب های سخت که حاوی غلظت بالایی از یونهای کلسیم و منیزیم هستند، ممکن است باعث ایجاد رسوبات زنگ زدگی در سیستمهای لولهکشی و تجهیزات تصفیه آب شوند و با افزودن سدیم به آب، یونهای کلسیم و منیزیم میتوانند جابجا شوند و از تشکیل رسوبات جلوگیری کنند.
4. کشاورزی
این عنصر میتواند در ترکیب سدیم نیترات، به عنوان یک کود شیمیایی به کار برود و موجب افزایش رشد در گیاهان شود. به طور کلی سدیم در کشاورزی به عنوان یکی از مواد کلیدی مورد استفاده قرار میگیرد که میتواند به بهبود خاک و رشد گیاهان کمک کند.
5. پخت و پز
به دلیل وجود سدیم در نمک طعام یا حتی جوش شیرین، این عنصر در پخت و پز نیز به عنوان طعم دهنده، مورد استفاده قرار میگیرد و در واقع بدون آن نمی توان برای پخت غذاهای مختلف اقدام کرد.
6. نظافت منزل
ترکیباتی همچون سدیم کربنات و جوش شیرین خاصیت سفیدکنندگی و تمیزکنندگی دارند. به همین علت برای نظافت منزل و همچنین پاک کردن سطوح مختلف، مورد استفاده قرار میگیرند.
7. پزشکی
ترکیبات مختلفی از سدیم مانند سدیم یدید برای یددار کردن نمک خوراکی و پیشگیری از گواتر، سدیم فلوراید برای پیشگیری از پوسیدگی دندانها، محلول نمکی برای درمان کم آبی بدن و یا شستشوی زخمها در عرصه پزشکی مورد استفاده قرار میگیرد.
سدیم خالص یا ترکیبات آن، کاربردهای متنوع دیگری دارند که برخی از آنها برای تولید موارد زیر است:
- کاغذ
- شیشه
- باتری
- لاستیک
- آلومینیوم
- مواد شوینده
نگهداری و مسائل ایمنی هنگام کار با سدیم
از آنجایی که سدیم فلزی بسیار واکنش پذیر و قلیایی می باشد، بهتر است تا حین نگهداری و یا استفاده از آن، نکات ایمنی زیر را رعایت کنید تا دچار مشکل و حادثه خطرناکی نشوید.
- فلز سدیم را با احتیاط جابجا کنید.
- از تماس آن با آب پرهیز کنید تا دچار انفجار هیدروژن نشود.
- سدیم را در داخل ظرف در بسته و به دور از رطوبت نگهداری کنید.
- هنگام جابجایی آن، از دستکش، عینک و روپوش ایمنی استفاده کنید.
- سدیم را در مکانی خشک و خنک و به دور از مواد اکسیدکننده یا اسیدی، نگهداری کنید.
نکات ایمنی حین کار با سدیم
سعی کنید حین کار با فلز سدیم و ترکیبات آن، نکات ایمنی زیر را رعایت کنید تا مشکلی برای شما پیش نیاید:
- با دست آلوده به سدیم چیزی نخورید تا دچار مسمومیت نشوید.
- در محلی که از آن استفاده میکنید حتماً تهویه مناسب داشته باشید.
- در صورت تماس سدیم با پوست، محل مورد نظر را بلافاصله با آب فراوان شستشو دهید.
- مراقب باشید تا این عنصر با پوست تماس نداشته باشد، چرا که منجر به سوختگی شیمیایی خواهد شد.
- استنشاق بخارات سدیم می تواند منجر به مشکلات تنفسی شود، پس بهتر است از ماسک یا نقاب استفاده کنید.
- در صورت استنشاق بخارات سدیم، به هوای تازه بروید و در صورت نیاز از تنفس مصنوعی استفاده کنید.
چه منابعی شامل سدیم هستند؟
منابع مختلفی وجود دارند که شامل مقادیر زیادی سدیم هستند. این منابع عبارتند از:
- غذاهای فرآوری شده
- نمک طعام (NaCl)
- برخی از داروها
- آب آشامیدنی
عملکرد سدیم در بدن چگونه است؟
همانطور که قبلتر هم گفتیم، مصرف سدیم برای انسان و سلامتی بدن، ضروری است. اما چرا استفاده از آنضرورت دارد؟ یا بهتر بگوییم، سدیم چه تاثیر و عملکردی بر بدن دارد که باعث میشود مصرف آن ضروری شود؟ برخی از این تاثیرات به شرح زیر هستند:
- کمک به انتقال پیام های عصبی
- تنظیم تعادل مایعات بدن
- انقباض عضلات
- تنظیم فشار خون
کلام پایانی
در این مطلب به طور کامل خصوصیات سدیم و کاربردهای آن را بررسی کردیم. باید گفت در مصارف صنعتی، سدیم به عنوان یک ماده محوری در تولید محصولات شیمیایی مورد استفاده قرار میگیرد. علاوه بر این، سدیم در زمینههای دیگری مانند پزشکی، تصفیه آب، کشاورزی و پخت و پز کاربردهای متعددی دارد.
از جمله خصوصیات جالب این عنصر میتوان به قابلیت آن برای تنظیم pH، نرم کنندگی آب و افزایش طعم و ماندگاری در غذاها اشاره کرد. به عنوان یک عنصر اساسی در سلولهای زنده، سدیم نقش بسیار مهمی در تعادل الکترولیتی بدن انسان دارد و اسیدیته معده را نیز تنظیم میکند. در مجموع، سدیم یکی از عناصر کلیدی در علم شیمی و صنایع مختلف است که تأثیرات مثبت گستردهای در زندگی روزمره دارد.
البته سدیم تنها عنصری نیست که در صنعت و زندگی روزمره کاربرد دارد. اکسیژن، آرگون، هیدروژن، هلیوم و … همگی از گازهایی هستند که در بسیاری از صنایع مورد استفاده قرار می گیرند. پارس هوای البرز عرضه کننده انواع این گازهای صنعتی با خلوص و کیفیت بسیار بالا است که محصولات خود را با استفاده از تکنولوژی های به روز و تجربه متخصصین مجرب ارائه می کند و فعالان در صنعت می توانند با خیال راحت به آن اعتماد کنند.
سوالات متداول در مورد سدیم
سدیم یک الکترون ظرفیت دارد که به راحتی می تواند آن را از دست بدهد و این امر باعث می شود که به شدت با سایر عناصر واکنش دهد.
خیر، نمک طعام (NaCl) ترکیبی از سدیم و کلر است.
با وجود اینکه کمبود سدیم در بدن نادر است، اما کمبود آن در بدن میتواند موجب شود تا اسهال و استفراغ و تعریق بیش از حد داشته باشید و یا سرگیجه، سردرد و گرفتگی عضلات را تجربه کنید.
مصرف بیش از حد سدیم میتواند منجر به فشار خون بالا و بروز بیماریهای قلبی و سکته مغزی شود. انجمن قلب آمریکا توصیه میکند که بزرگسالان سالم، روزانه بیش از ۲۳۰۰ میلی گرم سدیم مصرف نکنند تا دچار مشکلات قلبی و عروقی نشوند.